即可将网页分享至朋友圈
近日,医学院张坤教授团队以第一作者单位在Nano-Micro Letters杂志发表了题为《Engineered Cancer Nanovaccines:A New Frontier in Cancer Therapy》的论文,医学院2022级本科生王艺洁和2021级本科生刘丛睿为共同第一作者,张坤教授为共同通讯作者。
论文全面总结了工程化癌症纳米疫苗目前的研究进展,分类讨论了癌症纳米疫苗的各类纳米载体、制备原理与临床应用,并对癌症纳米疫苗目前存在的毒性、临床转化、大规模生产等方面的问题和未来发展方向提出可行性建议。
癌症是威胁人类生命健康的重大疾病之一,常用的放化疗与手术治疗经常无法达到预期治疗目的。而工程化癌症纳米疫苗可以利用疫苗的特点,引起机体自身强大的抗肿瘤免疫反应,可以有效杀伤癌细胞并产生长效的免疫记忆。工程化癌症纳米疫苗由纳米颗粒载体和其内部的肿瘤抗原两部分组成,纳米载体可分为无机纳米颗粒、脂质纳米颗粒、聚合物纳米颗粒、仿生纳米颗粒。癌症纳米疫苗可靶向树突状细胞、T细胞、癌细胞等多种细胞引起免疫反应。
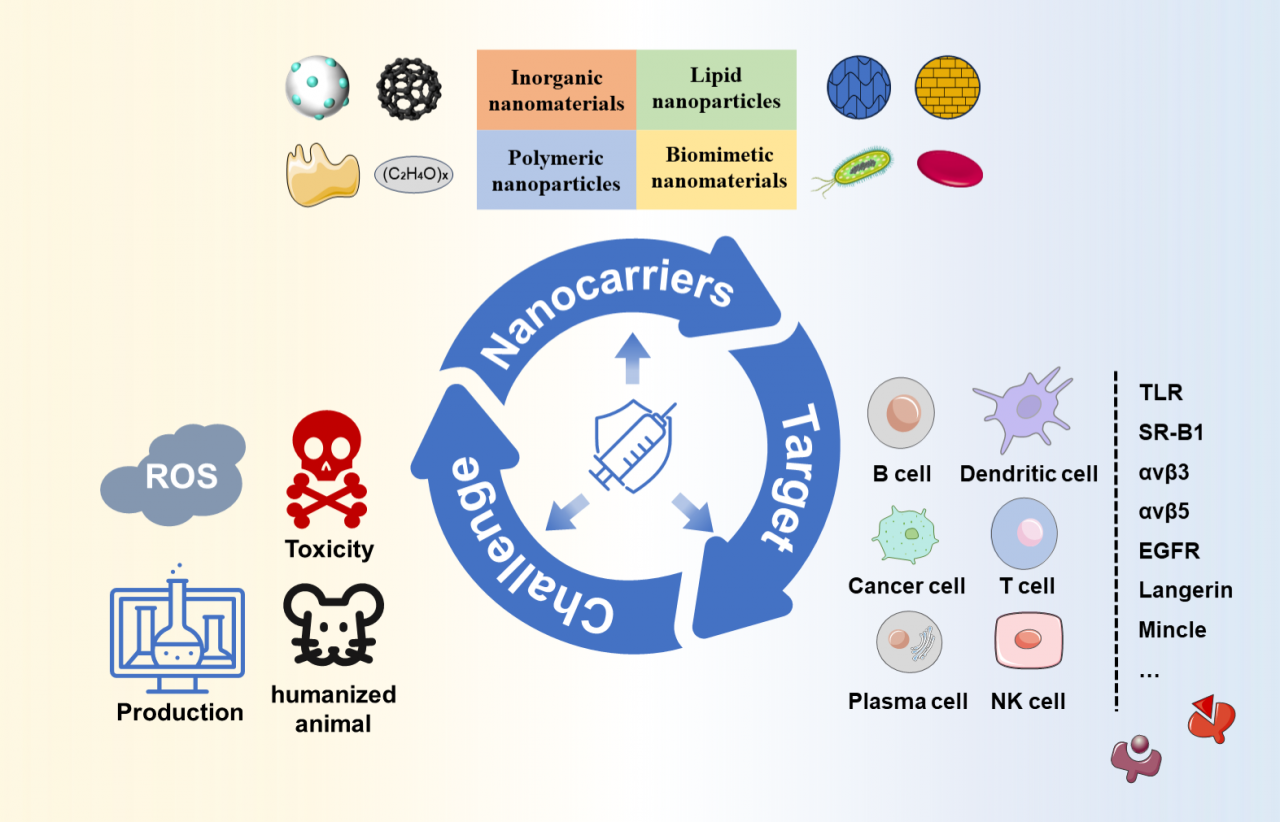
图1. 工程化癌症纳米疫苗的载体、靶点和存在的问题
在设计与制备癌症纳米疫苗中,有多种靶向策略可以选择。常见的有靶向树突状细胞DCs上的C型凝集素受体(CLRs)包括DEC205 (CD205)、Langerin、CLEC9A、Mincle等、清道夫受体SR-B1和Toll样受体(TLRs)等。还可以利用树突状细胞来直接靶向体内的T细胞、利用癌细胞上的αvβ3和αvβ5整合素、高表达的SR-B1和EGFR来递送细胞毒性药物和肿瘤抗原。此外利用ADCC效应、ADCP效应和CDC效应也可以触发T细胞+B细胞这类混合免疫反应,激活CD8+T细胞与抗体同时杀灭癌细胞。
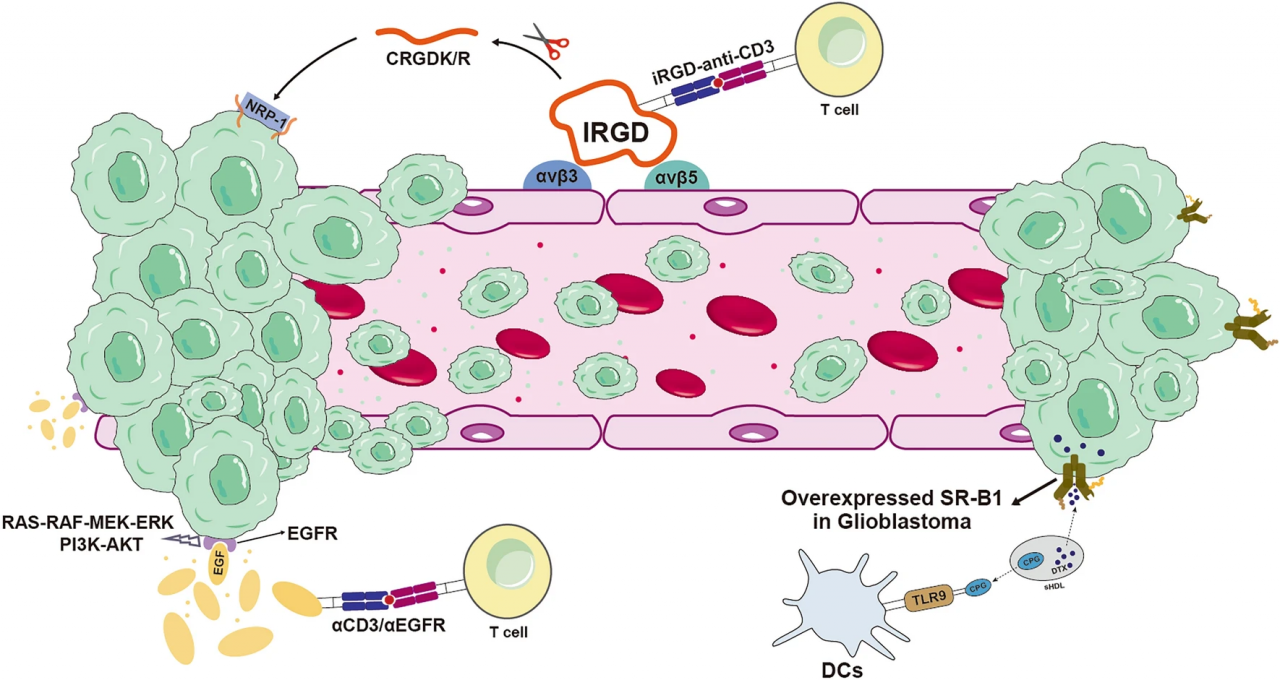
图2.iRGD可以与肿瘤组织内血管上高表达的αvβ3和αvβ5整合素结合,经过酶切生成CRGDK/R,该肽能够结合NRP-1,从而促进药物穿透癌细胞膜。此外,一些癌细胞膜上还过表达蛋白受体,如EGFR和SR-B1,它们也可以作为癌细胞的靶点。
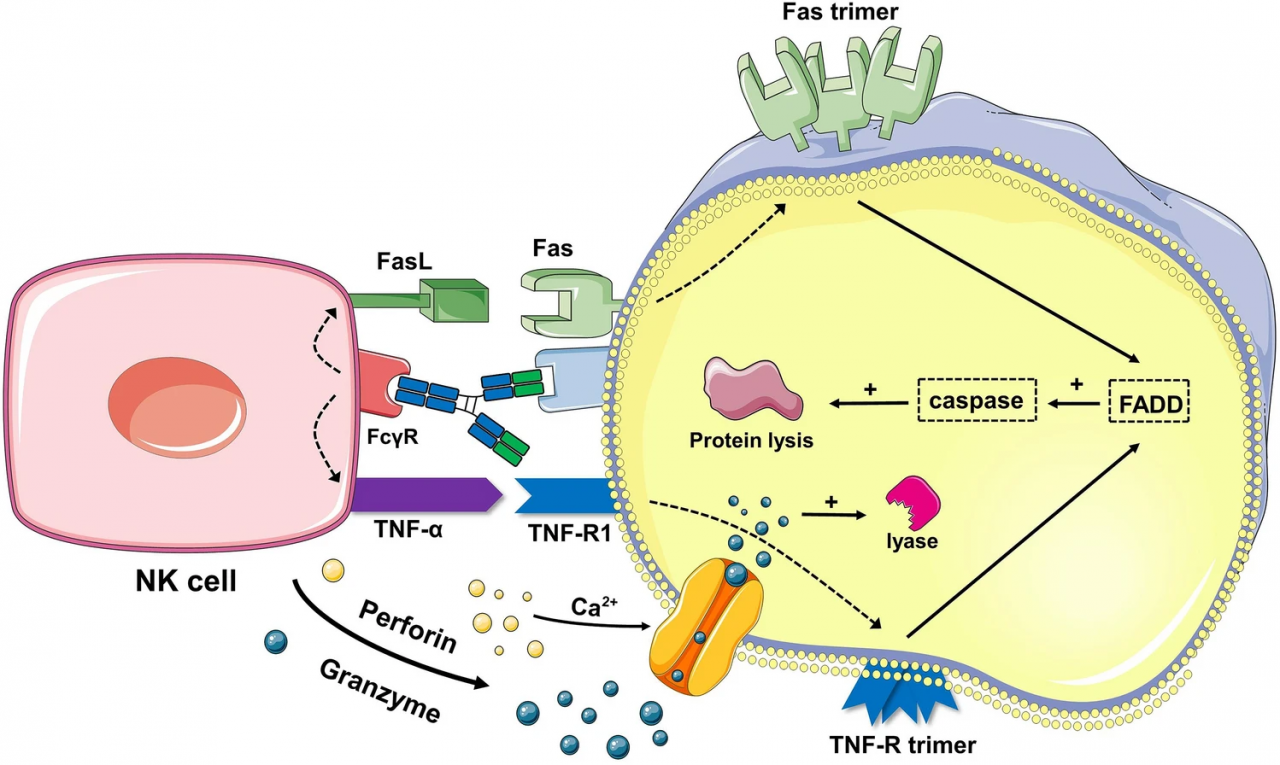
图3. ADCC机制示意图。当抗体的Fab片段与靶细胞上的受体结合时,自然杀伤细胞(NK细胞)上的Fc片段受体与抗体的Fc片段结合,触发NK细胞释放肿瘤坏死因子(TNF)并与Fas结合的FasL,诱导靶细胞上TNF-R和Fas三聚体的形成。这一激活过程导致靶细胞内Caspase蛋白的激活,切割细胞内蛋白。同时,NK细胞释放穿孔素和颗粒酶,激活Caspase蛋白。这两个过程同时进行,以杀死靶细胞。
癌症纳米疫苗已经在动物体内取得了良好的抗肿瘤效果,但是如何将其转化进入临床应用仍然有许多困难需要解决,包括疫苗的安全性、有效性和生物相容性等。目前对纳米疫苗的长期效果和潜在副作用的研究仍然不足,实验动物体内的靶点与人类可能不尽相同,在实验中取得的疗效不一定在人类中有相同效果,因此需要更多的长期临床数据来评估其安全性和有效性。同时,纳米疫苗的生产过程可能面临规模化和标准化的困难,这可能影响其临床应用的可行性。但得益于纳米科学、材料学与生物学的不断进步,癌症纳米疫苗仍然是非常有前途的癌症免疫疗法。
张坤教授团队长期从事超声诊疗、介入热消融、肿瘤、免疫、纳米医学、再生医学、神经调控等生物医学工程与多学科交叉方向研究,近年来以第一或通讯在Adv Mater 、Nat Commun 等杂志发表SCI论文60余篇,5篇ESI高被引论文,2篇热点论文。
论文链接:https://link.springer.com/article/10.1007/s40820-024-01533-y#author-information
编辑:罗莎 / 审核:李果 / 发布:陈伟


