即可将网页分享至朋友圈
近日,医学院赵越副研究员课题组在国际知名高水平医学期刊 Theranostics 上发表题为《Sex bias in tumor immunity: insights from immune cells》的综述文章,全面、系统地阐述了性激素、性染色体与表观遗传因素如何共同塑造肿瘤免疫当中多种免疫细胞的性别差异化,为该领域研究提供了重要基础,同时也为个体化肿瘤治疗提供了全新视角。
电子科技大学医学院2022级本科生陶学锐为第一作者,医学院王伊玲副研究员、医学院2022级硕士生向炳华、胡冬梅为共同第一作者,医学院赵越副研究员为第一通讯作者。
临床研究已明确观察到癌症发病率、免疫疗法反应以及不良反应敏感性方面存在显著的性别差异。理解这些差异背后的机制,对于发展个性化癌症治疗方案至关重要。
雌激素受体α(ERα)通过调节多种白细胞介素(IL-4、IL-5、IL-6、IL-10和IL-13)促进Th2细胞分化,同时抑制Th1免疫反应。ERα还增强调节性T细胞(Tregs)的增殖和关键基因表达,有助于形成免疫耐受环境。而雌激素受体β(ERβ)则通过多种信号通路调节T细胞功能,在膀胱癌、子宫内膜癌和非小细胞肺癌等多种肿瘤中发挥作用。雄激素受体(AR)信号则通过诱导USP18和抑制NF-κB通路,抑制T细胞活化和功能,导致免疫检查点分子表达增加和CTL(细胞毒性T淋巴细胞)耗竭。性染色体失活逃逸(XCI)和Y染色体缺失(LOY)也对T细胞功能产生深远影响,改变Th1/Th2通路相关基因表达,影响癌症易感性。
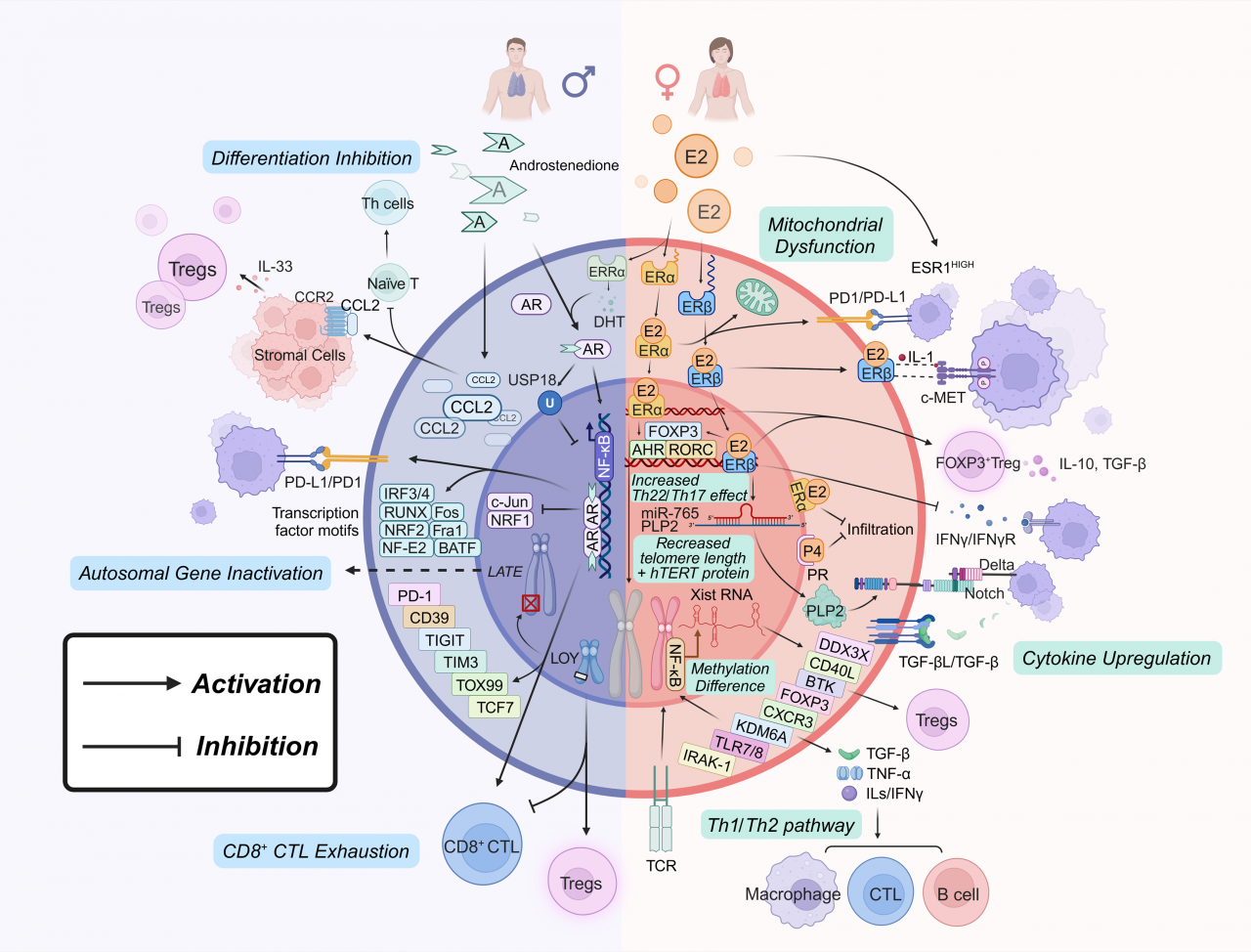
图1 肿瘤免疫中T细胞的性别差异
雌激素通过与ERα和ERβ相互作用,促进B细胞活化、抗体生成和肿瘤微环境内成熟。雌激素增强生长因子受体信号传导,激活PI3K和MAPK通路,产生促肿瘤效应,包括促进三级淋巴样结构(TLS)形成。相比之下,雄激素通过AR抑制B细胞招募和抗体产生,降低抗体成熟度。AR通路通过增强调节性B细胞(Bregs)中IL-10的产生,负向调节B细胞功能。此外,GPR174信号传导抑制生殖中心内B细胞的聚集和功能,进一步抑制抗体产生和免疫反应。在女性体内,X染色体失活逃逸导致TLR7和BTK等关键基因过度表达,TLR7与雌激素信号结合后上调IFI44L/BAFF通路,强化免疫球蛋白成熟和自身免疫反应。性激素还引起B细胞表观遗传学改变,影响肿瘤免疫,可能导致癌症产生抗雌激素抗性和耐药性。
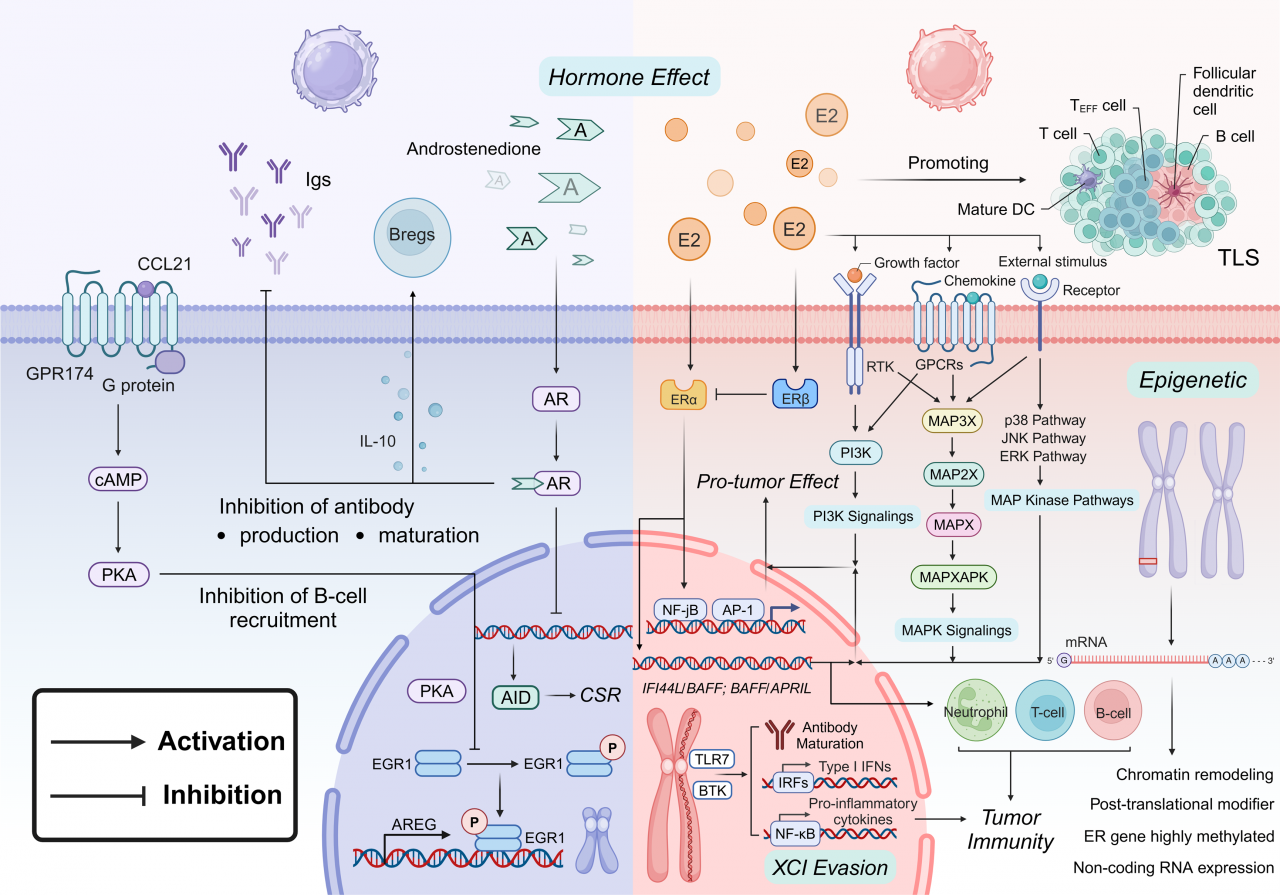
图2 肿瘤免疫中B细胞的性别差异
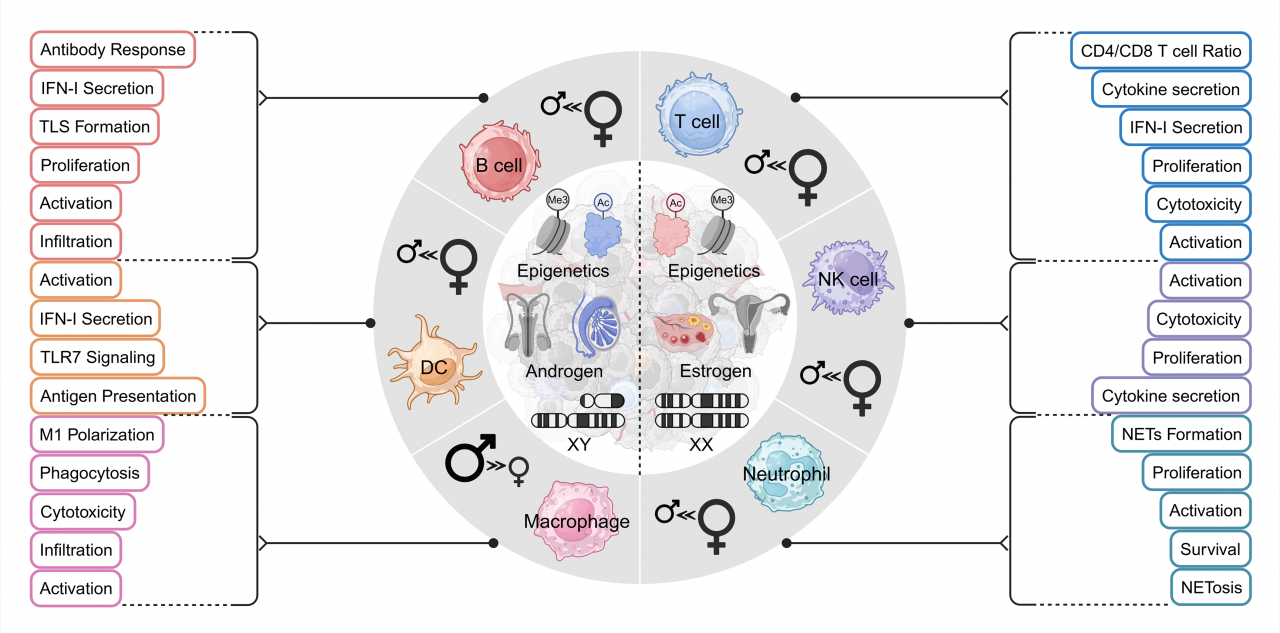
除此之外,研究还发现NK细胞、树突状细胞、中性粒细胞、巨噬细胞以及先天淋巴样细胞在肿瘤免疫效应中均存在性别差异。多种生物分子(如Activin/Inhibin、胆汁酸、DHEA和胶原蛋白等)也表现出明显的性别二向性。基因表达的表观遗传调控、细胞衰老、微生物组成、代谢和DNA损伤反应方面存在的性别差异,共同影响抗肿瘤免疫和免疫疗法的疗效。
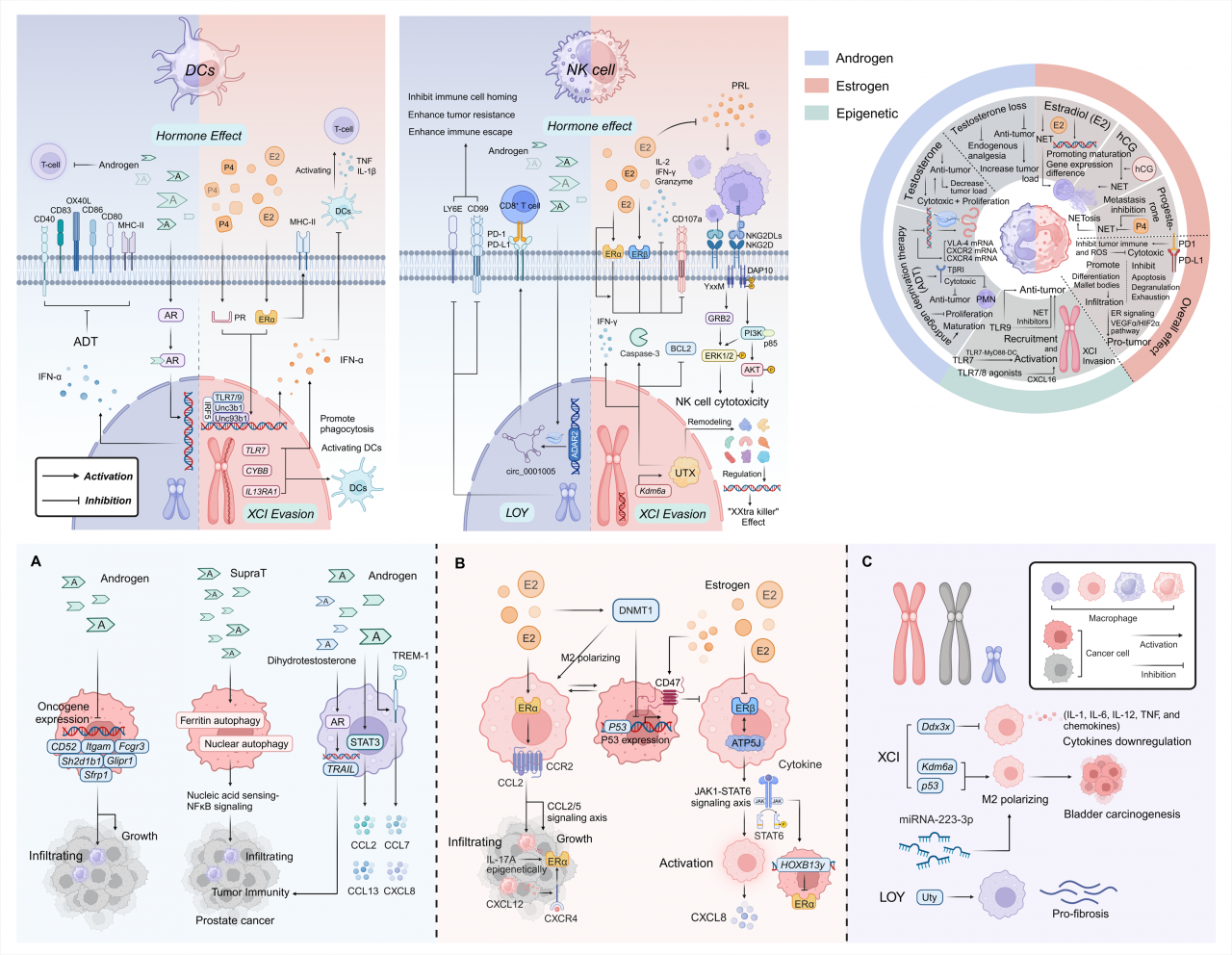
图3 肿瘤免疫中NK细胞、DC细胞、中性粒细胞和巨噬细胞的性别差异
综上所述,性染色体、性激素和激素受体的复杂互动共同调控着参与肿瘤免疫的各类免疫细胞的表型和功能。考虑到激素受体在免疫细胞中的差异性表达,以及性激素水平在不同生命阶段的显著波动,每种免疫细胞的性别差异都具有情境和环境依赖性。这些研究发现为设计性别特异性靶向疗法提供了重要理论基础,有望推动更加个性化、精准的癌症治疗策略的制定,为患者带来最佳疗效。
文章链接:https://www.thno.org/v15p5045.htm
编辑:张闻起 / 审核:李果 / 发布:陈伟


