即可将网页分享至朋友圈
近日,生命科学与技术学院刘贻尧/吴春惠教授团队在学术期刊 Bioactive Materials 在线发表了最新研究进展《Smart Biomimetic “Nano-Med-fireman” Blocking Inflammation and Lactate Metabolism Crosstalk for Normalized Spatiotemporal Photo-immunotherapy》(智能仿生“纳米医疗消防员”阻断炎症和乳酸代谢串扰实现低炎症光热免疫治疗)。
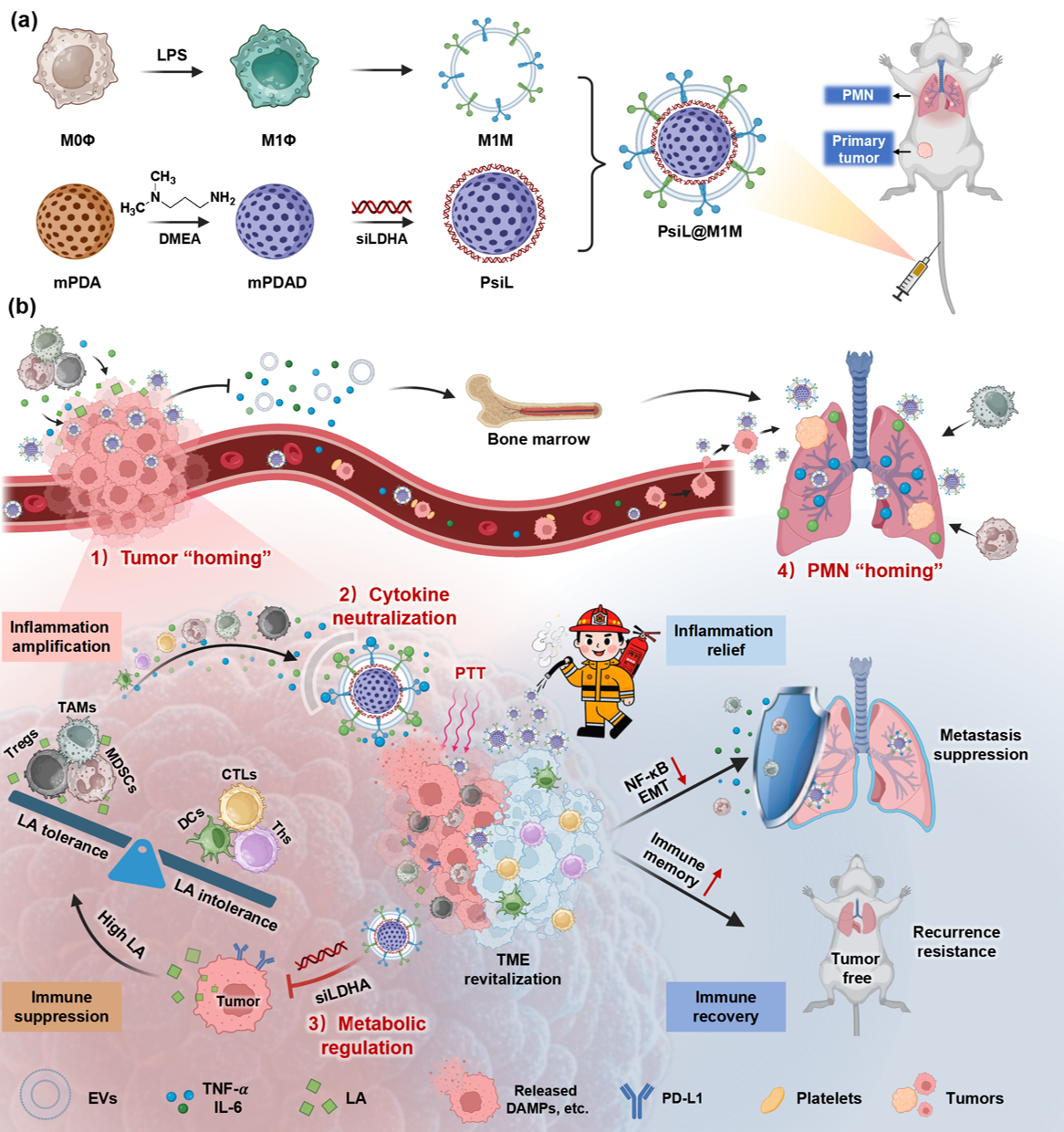
针对实体肿瘤错综复杂的微环境严重制约肿瘤免疫治疗疗效的瓶颈问题,本研究以三阴性乳腺癌为治疗目标,创新性提出了仿生“纳米医疗消防员”PsiL@M1M治疗平台。它具有炎症趋向性,通过阻断传统光热治疗(PTT)引起的过度炎症和异常乳酸代谢串扰,重塑免疫抑制性肿瘤微环境,增强细胞毒性T淋巴细胞抗肿瘤效果,显著抑制肿瘤转移和复发。总体而言,PsiL@M1M作为新一代光热免疫调节剂,通过肿瘤微环境多因素的综合调节,减少了传统光热治疗的炎症副作用,实现了安全有效的癌症免疫治疗,具有较高的临床转化潜力。电子科技大学为第一完成单位,吴春惠教授、刘贻尧教授和王登凤教授为该论文的共同通讯作者,生命科学与技术学院博士生黄虹霖为论文第一作者。

传统PTT后的过度炎症反应与肿瘤固有的乳酸代谢异常协同加速了肿瘤上皮-间质转化(EMT)、转移前生态位(PMN)形成和免疫抑制,可能是恶性肿瘤微环境的“幕后黑手”。受到炎性细胞膜表面高表达炎性细胞因子受体的启发,研究团队设计了M1型巨噬细胞膜伪装的搭载乳酸调控siLDHA的mPDA纳米“消防员”,通过抑制PTT过度炎症与肿瘤异常乳酸代谢,协同实现更安全高效的光热免疫抗肿瘤治疗。PsiL@M1M保留了M1型巨噬细胞表面的炎性细胞因子受体(如TNF-α受体和IL-6受体),能够在细胞水平及动物水平“中和”炎性细胞因子,阻断其介导的炎症信号通路,避免PTT后引起的炎症级联反应(如EMT过程)。进一步联合代谢干预策略,PsiL@M1M阻断了炎性细胞与免疫细胞的“通讯串扰”,最大程度上重构了肿瘤的免疫抑制环境。PsiL@M1M的炎症趋向性特性使其不仅能够靶向原发乳腺癌,还能靶向缓解肺部PMN炎症微环境,从转移起始和终点“跨器官”抑制肿瘤的自发转移。进一步,PsiL@M1M在更严峻的复发肿瘤模型中,再次接种乳腺癌4T1细胞八周后仍有60%小鼠存活,并且展示出良好的生物安全性。基于该研究,已申请了国家发明专利1项。
本研究得到了国家自然科学基金项目和四川省自然科学基金等项目的支持。
论文链接:https://doi.org/10.1016/j.bioactmat.2025.05.012
编辑:罗莎 / 审核:李果 / 发布:陈伟


